Damit ein defektes Gen nicht zur Erblindung führt
27.8.2019, 13:23 Uhr
Inzwischen kennt die Wissenschaft viele Gene, bei denen vererbte oder spontan auftretende Mutationen zu einer krankhaften Veränderung der Netzhaut führen. Eines davon ist das Gen RPE65.Es wird autosomal rezessiv vererbt, das heißt, die Krankheit tritt nur in Erscheinung, wenn sowohl Mutter als auch Vater das fehlerhafte Gen an das Kind weitergegeben. Die Erkrankung ist daher vergleichsweise selten.
Eine erbliche Veränderung der Netzhaut (Retina), bei der die Sehzellen nach und nach zerstört werden, wird Retinitis pigmentosa (RP) genannt. Sie führt bereits in frühem Kindesalter zu Nachtblindheit und später zu einer fortschreitenden Einschränkung des Gesichtsfeldes mit Tunnelblick. Die Betroffenen können noch viele Jahre mehr oder weniger gut sehen. Doch die meisten Patienten erblinden im fortgeschrittenen Zustand der Erkrankung.
„Es sind inzwischen circa 100 Gene bekannt, deren Mutationen zu einer RP führen können“, sagt Prof. Ulrich Kellner, Ärztlicher Leiter des Augenzentrums Siegburg. Das defekte Gen RPE65 sei also nur in etwa einem Prozent aller Fälle ursächlich
Aufwändige Untersuchung
Da der Gendefekt nur mittels einer aufwändigen molekulargenetischen Untersuchung feststellbar sei, wisse niemand, wie vielen Menschen in Deutschland von der Gentherapie „Luxturna“ profitieren könnten. „Schätzungen gehen von etwa 200 bis 300 Patienten aus“, so Kellner.
Der Gendefekt führt letztlich zu einer Zerstörung der Stäbchen, das sind jene Sinneszellen in der Netzhaut, die vor allem für das Sehen in der Dämmerung und bei Nacht zuständig sind. Dazu brauchen sie das lichtempfindliche Sehpigment Rhodopsin in Kombination mit Vitamin A. Stäbchen ohne Rhodopsin degenerieren und sterben ab.
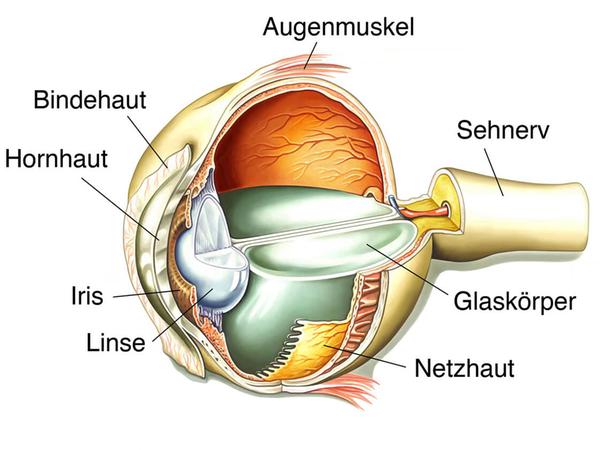
Rhodopsin wird beim Sehvorgang verändert und muss daher ständig regeneriert werden. Die Mutation auf RPE65 behindert jedoch die Aktivität eines Enzyms, das für diesen Recyclingprozess von Vitamin A notwendig ist. Der Prozess läuft in der untersten Schicht der Netzhaut ab, dem retinalen Pigmentepithel.
Bei der seit November 2018 in Europa zugelassenen Gentherapie „Luxturna“ wird ein gentechnisch veränderter und dadurch harmloser Virus vor das retinale Pigmentepithel gespritzt. Er transportiert eine korrekte Kopie des Gens in die Zelle und repariert so den Defekt. Damit kann der Recyclingprozess in der Zelle wieder normal ablaufen. In degenerierten Zellen oder solchen, die von dem Virus nicht befallen werden, funktioniert er weiterhin nicht oder nicht vollständig. Die Gentherapie ist also nur erfolgreich, wenn noch genügend lebensfähige Epithelzellen bzw. Stäbchen vorhanden sind.
Daher ist sie bereits für Kinder ab dem zweiten Lebensjahr zugelassen. Die deutschen Augenärzte hätten sich jedoch auf ein Mindestalter von vier Jahren verständigt, sagt Prof. Birgit Lorenz, Direktorin der Augenklinik des Universitätsklinikums Gießen und Marburg. In den USA seien schon über 80 Patienten mit „Luxturna“ behandelt worden.
Das „Medikament“ werde bei -81°C aufbewahrt, sagt Prof. M. Dominik Fischer vom Zentrum für Augenheilkunde des Universitätsklinikums Tübingen. Der Transport von der Apotheke in den OP müsse exakt geplant werden, da die Injektion unter die Netzhaut innerhalb von vier Stunden nach dem Auftauen erfolgen müsse.
Die Behandlung könne nur einmal durchgeführt werden, erklärt Kellner. „Die Gentherapie Luxturna kostet für beide Augen circa 823 000 Euro zuzüglich der Behandlungskosten.“ Verhandlungen mit den Krankenkassen über die Kostenübernahme stünden noch aus.
Die Gentherapie „Luxturna“ ist deutschlandweit die erste im Bereich der Augenheilkunde. Sie wird von den auf Seltene Erkrankungen spezialisierten Zentren an den Universitätskliniken Bonn, Gießen, München und Tübingen angeboten>
Keine Kommentare
Um selbst einen Kommentar abgeben zu können, müssen Sie sich einloggen oder sich zuvor registrieren.
0/1000 Zeichen

